ジェネリック医薬品(後発医薬品)について
印刷用ページを表示する 掲載日:2016年2月15日更新
先発医薬品(これまで使われてきた新薬)の特許が切れた後に医薬品メーカーが製造・販売する「ジェネリック医薬品(後発医薬品)」は、厚生労働省から「先発医薬品と同じ有効成分を同量含んでおり、(先発医薬品と)同等の効き目がある」と認められた医薬品です。それまで使われていた先発医薬品に比べて薬の値段が4割~5割程度安くなるため、ジェネリック医薬品の普及によって、一人ひとりの自己負担や国の財政・健康保険組合の負担などの削減、ひいては高齢化社会の進展によって増大を続ける国民医療費の抑制にもつながります。特徴やメリットを理解していただき、ぜひジェネリック医薬品をご活用ください。(本文については、「政府広報オンライン」からの転載しております。)
ジェネッリク医薬品(後発医薬品)とは?
医薬品には、一般の薬局・薬店で販売されている「一般用医薬品」と、医療機関で診察を受けたときに医師から処方される「医療用医薬品」があります。さらに、「医療用医薬品」には、新しく開発・販売される「先発医薬品(新薬)」と、先発医薬品の特許が切れた後に先発医薬品と同じ有効成分を同量含み、他の医薬品メーカーにより製造・販売される「後発医薬品」があり、後者を「ジェネリック医薬品」(※)とも言います。
※欧米では一般名(generic name)で処方することが多いため、「ジェネリック医薬品」と呼んでいます。
図表:医薬品の種類
※欧米では一般名(generic name)で処方することが多いため、「ジェネリック医薬品」と呼んでいます。
図表:医薬品の種類

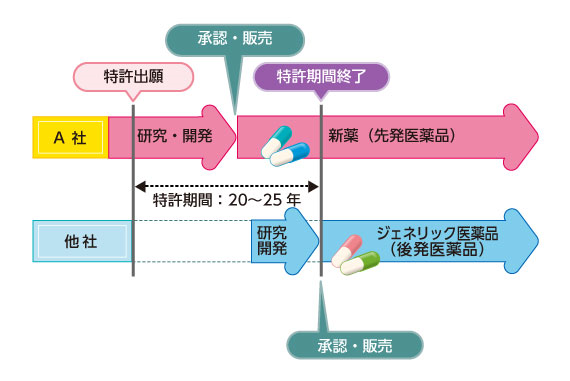
先発医薬品を開発した医薬品メーカーには、その新薬を独占的に販売できる特許期間(20~25年)があり、その期間が終了すると、新薬に使われた有効成分や製法などは国民共有の財産になります。そして、厚生労働大臣の承認を得られれば、他の医薬品メーカーでも「ジェネリック医薬品」として製造・販売が可能になります(下図参照)。
複数の医薬品メーカーが製造するジェネリック医薬品には、高血圧や高脂血症、糖尿病、花粉症といった様々な病気・症状に対応するものがある上、その形態もカプセル・錠剤など多様です。
図表:新薬の特許有効期間とジェネリック医薬品
複数の医薬品メーカーが製造するジェネリック医薬品には、高血圧や高脂血症、糖尿病、花粉症といった様々な病気・症状に対応するものがある上、その形態もカプセル・錠剤など多様です。
図表:新薬の特許有効期間とジェネリック医薬品
※ 本文および図表については、「政府広報オンライン」からの転載しております。
※ ジェネリック医薬品に関する他の情報をご覧になりたい方は下記の「政府広報オンライン」にリンクしてください。
・どんなメリットがあるの?
・効き目や安全性は大丈夫?
・使用するにはどうすればいいの?
・ジェネリック医薬品の普及に向けて
※ ジェネリック医薬品に関する他の情報をご覧になりたい方は下記の「政府広報オンライン」にリンクしてください。
・どんなメリットがあるの?
・効き目や安全性は大丈夫?
・使用するにはどうすればいいの?
・ジェネリック医薬品の普及に向けて
ジェネリック医薬品差額通知について
喜多方市国民健康保険では、年2回(平成27年度現在)、9月上旬と3月上旬に国民健康保険に加入している被保険者の方で下記の条件を満たしている方に情報提供として「ジェネリック医薬品使用促進のお知らせ(ジェネリック医薬品差額通知)」を送付しております。
※本通知の送付の停止をご希望される方は、お手数ですが下記のお問い合わせ先まで「停止したい」旨をご連絡ください。
○分析対象レセプト
減額効果を分析するレセプトは、6月請求(5月診療分)、12月請求(11月診療分)前に請求された診療報酬明細書および調剤報酬明細書(以下「レセプト」という。)のうち、電子媒体(オンライン請求を含む)により提出されたもので調剤レセプトと医科入院外レセプトを対象とします。
なお、紙媒体で請求されたレセプトなど一部のレセプトについては、分析の対象といたしません。
○作成対象者について
レセプトの分析をした結果、慢性疾患を有する被保険者で自己負担額が100円以上減額すると見込まれる被保険者を、差額通知書の作成対象被保険者とします。
なお、慢性疾患を有する被保険者とは、つぎの表に記載の薬剤が処方された被保険者とします。
※本通知の送付の停止をご希望される方は、お手数ですが下記のお問い合わせ先まで「停止したい」旨をご連絡ください。
○分析対象レセプト
減額効果を分析するレセプトは、6月請求(5月診療分)、12月請求(11月診療分)前に請求された診療報酬明細書および調剤報酬明細書(以下「レセプト」という。)のうち、電子媒体(オンライン請求を含む)により提出されたもので調剤レセプトと医科入院外レセプトを対象とします。
なお、紙媒体で請求されたレセプトなど一部のレセプトについては、分析の対象といたしません。
○作成対象者について
レセプトの分析をした結果、慢性疾患を有する被保険者で自己負担額が100円以上減額すると見込まれる被保険者を、差額通知書の作成対象被保険者とします。
なお、慢性疾患を有する被保険者とは、つぎの表に記載の薬剤が処方された被保険者とします。
| No. | 薬効 分類番号 |
薬効中分類 | 剤形 |
|---|---|---|---|
| 1 | 211 | 強心剤 | 全て |
| 2 | 214 | 血圧降下剤 | 〃 |
| 3 | 217 | 血管拡張剤 | 〃 |
| 4 | 218 | 高脂血症剤 | 〃 |
| 5 | 245 | 副腎ホルモン剤 | 〃 |
| 6 | 396 | 糖尿病用剤 | 〃 |
| 7 | 264 | 鎮痛,鎮痒,収斂,消炎剤 | ハップ剤 |
ジェネリック医薬品使用促進のお知らせ(差額通知)の見本

ジェネリック医薬品等に関するリンク集
厚生労働省のジェネリック医薬品に関するサイト<外部リンク>
独立行政法人医薬品医療機器総合機構(PMDA;Pharmaceuticals and Medical Devices Agency)は、平成13年に閣議決定された特殊法人等整理合理化計画を受けて、国立医薬品食品衛生研究所医薬品医療機器審査センター、医薬品副作用被害救済・研究振興調査機構および財団法人医療機器センターの一部の業務を統合し、独立行政法人医薬品医療機器総合機構法に基づいて平成16年4月1日に設立され、業務を開始しました。
PMDAは、医薬品の副作用や生物由来製品を介した感染等による健康被害に対して、迅速な救済を図り(健康被害救済)、医薬品や医療機器などの品質、有効性および安全性について、治験前から承認までを一貫した体制で指導・審査し(承認審査)、市販後における安全性に関する情報の収集、分析、提供を行う(安全対策)ことを通じて、国民保健の向上に貢献することを目的としています。(本文については、「独立行政法人医薬品医療機器総合機構(PMDA)」からの転載しております。)
PMDAは、医薬品の副作用や生物由来製品を介した感染等による健康被害に対して、迅速な救済を図り(健康被害救済)、医薬品や医療機器などの品質、有効性および安全性について、治験前から承認までを一貫した体制で指導・審査し(承認審査)、市販後における安全性に関する情報の収集、分析、提供を行う(安全対策)ことを通じて、国民保健の向上に貢献することを目的としています。(本文については、「独立行政法人医薬品医療機器総合機構(PMDA)」からの転載しております。)
独立行政法人医薬品医療機器総合機構(PMDA)<外部リンク>
